Serotonina, cortisol e destruição do tecido cerebral
Mais evidências sobre o papel nefasto da serotonina e do cortisol contra o cérebro
[Imagem: Channel Neuroscientifically Challenged]
A experiência a seguir já foi feita mais de uma vez e, ao contrário da lenda – da serotonina amiga do humor e do prazer - , mostra o efeito bioquímico negativo da serotonina no cérebro.
Esta molécula inflamatória também afeta outros sistemas do organismo, mas o foco da experiência a seguir foi o cérebro. O título do paper científico já anuncia o resultado da pesquisa: “Serotonina induz decréscimo do ATP cerebral”...
Bem simples em seu método, a experiência consistiu em injetar serotonina, em ratos e observer os efeitos cerebrais em laboratório, incluindo marcadores como lactato, ATP e outros.
O resultado [A] segundo os autores: “dramática queda nos níveis de ATP cerebral, estimulação significativa da glicólise anaeróbica, com marcante aumento do conteúdo de lactato no cérebro” [A] são todas mudanças induzidas pela serotonina e que são características de isquemia cerebral.
Também houve elevação da hemoblogina plasmática sugerindo lise [destruição] de hemácias.
Esses efeitos da serotonina [5-hidroxitriptamina] são conhecidos a partir de outras experiências e podem mudar de intensidade conforma a dose injetada, mas o padrão não muda: a serotonina cria um estado de isquemia cerebral de baixa intensidade, também observado na hibernação.
Aliás, hibernação é um estado reconhecidamente promovido pela serotonina [B]. Nos humanos isso se expressa como indução – pela serotonina - de um sono leve, superficial [a pessoa desperta ao menor ruído] e que, portanto, não é recuperador como o sono profundo não-induzido por serotonina.
O fato de a serotonina aumentar a queima anaeróbica de açúcar no cérebro, com aumento do ácido lático, é outro péssimo componente da sua ação. O ácido lático é semitóxico, como se sabe.
E essa forma de respiração é a mais ineficiente; o organismo costuma se socorrer dela – adaptativamente - no exercício extenuante e no metabolismo do câncer; nos dois casos, um claro desvio metabólico para uma respiração não mitocondrial. Não saudável.
Outra observação sobre o efeito da serotonina no cérebro, diz respeito ao comprometimento da performance da memória espacial. Foi observado, em trabalho de 1994, em New York [C], que o submetimento a exposição ao estresse, 6 horas por dia por 21 dias, provocou um comprometimento relativo da memória.
Foi um problema reversível, limitado no tempo, mas o interessante é que foi experimentalmente bloqueado pelo uso de droga anti-serotonina, que baixa os níveis de serotonina no cérebro, a tianeptina. [Tianeptina é um antiserotoninérgico que é eventualmente usado como antidepressivo, mas funciona, ao contrário dos antidepressivos mais comuns do mercado, baixando os níveis da serotonina em vez de aumentá-los, como fazem os antidepressivos tetracíclicos, por exemplo].
[Imagem: Channel Neuroscientifically Challenged]
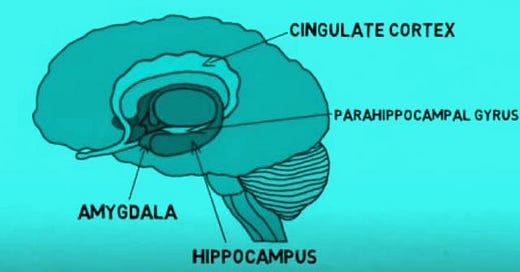
Naquele processo de estresse, observou-se também uma atrofia induzida pelo estresse de dendritos do hipocampo [células cerebrais][E].
Naturalmente trabalhos como este não são amplamente divulgados, jamais se tornam manchetes da BigMidia e constituem uma informação que o psiquiatra, por falta de tempo para estudar e total abdução pelos congressos médicos [patrocinados pela Big Pharma] provavelmente não teve acesso. Talvez por isso ele continue repetindo o mantra da serotonina-molécula-do-prazer quando, no mundo real ela é destrutiva, ao longo do tempo, para as funções cerebrais.
Um dado importante, bem conhecido pela neurologia, é o de que são características da idade, no caso de muitos indivíduos, a atrofia ou disfunção do hipocampo e essa disfunção precede a demência.
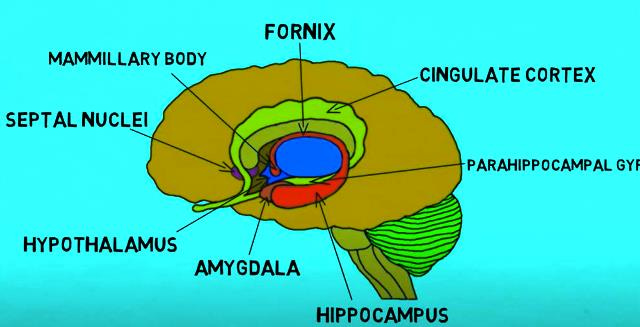
Uma molécula claramente envolvida nessa destruição de funções cerebrais é o cortisol [D]. Portanto, um hormônio do estresse, cortisol, foi visto como vinculado à atrofia do hipocampo em humanos. O que vem acompanhado de déficit da memoria verbal de curto prazo.
Os cientistas se perguntam como deter aquela atrofia.
Um trabalho de 1997, com ratos, adotou o pressuposto de que não somente cortisol, mas a serotonina, cumprem papel chave naquela degeneração, como estressores células nervosas.
Investigaram então a ação de drogas que aumentam serotonina e outras que a inibem [C].
No primeiro grupo um antidepressivo dos mais comuns, a fluoxetina, que aumenta o pool de serotonina cerebral [ao agir como inibidor da recaptação da serotonina sintetizada pelo corpo] e no segundo grupo, a tianeptina que inibe o pool de serotonina [ao reforçar a recaptação da serotonina].
O resultado foi claro, a droga anti-serotonina [tieneptina] impediu a atrofia dos dendritos, ao passo que a droga pró-serotonina [fluoxetina] não teve qualquer efeito de melhora do quadro neural.
Serotonina pelo que se vê aqui, mais uma vez, tem efeito disrruptivo sobre o tecido cerebral. Portanto, droga que aumenta serotonina – caso de antidepressivos comuns - impacta negativamente o tecido neural cerebral.
Também mostraram que uma droga que inibe o cortisol tem efeito semelhante. Ou seja, serotonina liberada pelo estresse [ou cortisol idem], estão unidos no mesmo papel de estressar o cérebro.
Sensatamente, os autores da pesquisa propõem que se discuta, a partir dessas considerações, levando em conta o papel nefasto da serotonina, a questão do risco de demência em idosos.
Como se sabe, o caminho escolhido pela Big Pharma e sua psiquiatria foi outro.
Ao invés de questionarem o papel negativo da serotonina, prescrevem amplamente drogas que aumentam o pool cerebral de serotonina.
São os antidepressivos.
[Existem três grandes tipos de antidepressivos, os inibidores de recaptação da serotonina e noradrenalina [SNRI], os inibidores seletivos de recaptação de serotonina [SSRI], eos inibidores de tripla receptação [SNDRIs]. Todos promovem a presença da serotonina, a exemplo do tetracíclico mirtazapina e seus colegas pirazidol, maprotilina, mianserina.
Além desse efeito de ir lesando o cérebro lentamente – podendo levar à demência tardia – impactam o organismo com um grande espectro de efeitos colaterais, em quase todos os sistemas do corpo e aumentam tendências suicidas, segundo a própria bula; e são cápsulas que costumam vir recheadas de lixo químico [tipo crospovidona, manitol, celulose microcristalina, aspartame, flavorizante morango guaraná, flavorizante menta, sílica coloidal anidra, estearato de magnésio que são os componentes de cada cápsula de, por exemplo, mirtazapina].Isto é, ao efeito destrutivo de longo prazo da droga antidepressiva promotora da serotonina agregam, no caso da mirtazapina, um combo químico com ao menos duas drogas cancerígenas].
Não é preciso comentar muito: eis a medicina como ela é, desenhada pelo mercado dos oligopólios de medicamentos, equipamentos e exames de imagens.
GM Fontes, 9-5-23. Brasília
As informações aqui presentes não pretendem servir para uso diagnóstico, prescrição médica, tratamento, prevenção ou mitigação de qualquer doença humana. Não pretendem substituir a consulta ao profissional médico ou servir como recomendação para qualquer plano de tratamento. Trata-se de informações com fins estritamente educativos.
Referências ______________________
[A] KOREN-SCHWARTZER, N, CHEN-ZION, M, 1994. Serotonin-induced decrease in brain ATP, stimulation of brain anaerobic glycolysis and elevation of plasma hemoglobin; the protective action of calmodulin antagonists. Gen Pharmacol. 1994 Oct;25(6):1257-62. doi: 10.1016/0306-3623(94)90147-3. PMID: 7875554DOI: 10.1016/0306-3623(94)90147-3 “1. Injection of serotonin (5-hydroxytryptamine) to rats, induced a dramatic fall in brain ATP level, accompanied by an increase in P(i). Concomitant to these changes, the activity of cytosolic phosphofructokinase, the rate-limiting enzyme of glycolysis, was significantly enhanced. Stimulation of anaerobic glycolysis was also reflected by a marked increase in lactate content in brain. 2. Brain glucose 1,6-bisphosphate level was decreased, whereas fructose 2,6-bisphosphate was unaffected by serotonin. 3. All these serotonin-induced changes in brain, which are characteristic for cerebral ischemia, were prevented by treatment with the calmodulin (CaM) antagonists, trifluoperazine or thioridazine. 4. Injection of serotonin also induced a marked elevation of plasma hemoglobin, reflecting lysed erythrocytes, which was also prevented by treatment with the CaM antagonists. 5. The present results suggest that CaM antagonists may be effective drugs in treatment of many pathological conditions and diseases in which plasma serotonin levels are known to increase.
[B] POPOVA N K VORONOVA P, 1993. Involvement of brain tryptophan hydroxylase in the mechanism of hibernation. Pharmacol Biochem Behav. 1993 Sep;46(1):9-13. doi: 10.1016/0091-3057(93)90309-h. PMID: 8255926 DOI: 10.1016/0091-3057(93)90309-h “Marked changes were revealed in the activity of the key enzyme in serotonin biosynthesis, tryptophan hydroxylase (TPH), during entry into hibernation, hibernation, and arousal in ground squirrels (Citellus erythrogenys). An increase in TPH activity was found in the midbrain, hippocampus, and striatum during the prehibernation period in euthermic ground squirrels. A further increase in TPH activity was observed during the entry into hibernation. Significant elevation was found not only in potential TPH activity measured at the incubation temperature of 37 degrees C but also at incubation temperature of 7 degrees C, approximating the body temperature in hibernation. Vmax in the midbrain of hibernating animals was about 50% higher than in active ones without significant changes in Km. Thus, brain TPH maintains functionality during torpidity and is activated before the entry into hibernation. The results support the idea that brain serotonin is crucially involved in the transition to and the maintenance of the hibernation state”.
[C] LUINE V VILLEGAS M, 1994. Repeated stress causes reversible impairments of spatial memory performance. Brain Res . 1994 Mar 7;639(1):167-70. doi: 10.1016/0006-8993(94)91778-7. PMID: 8180832 DOI: 10.1016/0006-8993(94)91778-7 “Restraint stress, 6 h/day for 21 days, caused an impairment, during acquisition, of the performance of a spatial memory task, the eight-arm radial maze. The impairment was reversible, temporally limited and blocked by phenytoin, a blocker of excitatory amino acid action, or tianeptine, an antidepressant, which lowers extracellular serotonin. These effects on behavior parallel the reversible stress-induced atrophy of dendrites of hippocampal CA3 neurons that are also blocked by the drugs”.
[D] McEWEN, B S, CONRAD,C D, 1997. Prevention of stress-induced morphological and cognitive consequences. European Neuropsychopharmacology. Volume 7, Supplement 3, 1 October 1997, Pages S323-S328. https://doi.org/10.1016/S0924-977X(97)00064-3Get rights and content. “Atrophy and dysfunction of the human hippocampus is a feature of aging in some individuals, and this dysfunction predicts later dementia. There is reason to believe that adrenal glucocorticoids may contribute to these changes, since the elevations of glucocorticoids in Cushing's syndrome and during normal aging are associated with atrophy of the entire hippocampal formation in humans and are linked to deficits in short-term verbal memory. We have developed a model of stress-induced atrophy of the hippocampus of rats at the cellular level, and we have been investigating underlying mechanisms in search of agents that will block the atrophy. Repeated restraint stress in rats for 3 weeks causes changes in the hippocampal formation that include suppression of 5-HT1A receptor binding and atrophy of dendrites of CA3 pyramidal neurons, as well as impairment of initial learning of a radial arm maze task. Because serotonin is released by stressors and may play a role in the actions of stress on nerve cells, we investigated the actions of agents that facilitate or inhibit serotonin reuptake. Tianeptine is known to enhance serotonin uptake, and we compared it with fluoxetine, an inhibitor of 5-HT reuptake, as well as with desipramine. Tianeptine treatment (10 mg/kg/day) prevented the stress-induced atrophy of dendrites of CA3 pycamidal neurons, whereas neither fluoxetine (10 mg/kg/day) nor desipramine (10 mg/kg/day) had any effect. Tianeptine treatment also prevented the stress-induced impairment of radial maze learning. Because corticosterone- and stress-induced atrophy of CA3 dendrites is also blocked by phenytoin, an inhibitor of excitatory amino acid release and actions, these results suggest that serotonin released by stress or corticosterone may interact pre- or post-synaptically with glutamate released by stress or corticosterone, and that the final common path may involve interactive effects between serotonin and glutamate receptors on the dendrites of CA3 neurons innervated by mossy fibers from the dentate gyrus. We discuss the implications of these findings for treating cognitive impairments and the risk for dementia in the elderly. Introduction - The hippocampus is a vulnerable brain structure that is involved in aspects of learning and memory, especially those aspects related to spatial memory and `working' memory [7]. Besides the actions of repeated stress, to be discussed below, the hippocampus is vulnerable to disruptive events such as seizures, head trauma and ischemia, as well as to degenerative changes accompanying aging 11, 15, 16, 28, 29. An important factor in damage to the hippocampus is the action of glucocorticoid hormones, which potentiate damage produced by ischemia and excitotoxins and mimic the effects of aging and stress in causing hippocampal damage [28]. A second factor in hippocampal damage is the endogenous excitatory amino acids [28], but there is a paradox, in that excitatory amino acids are also involved in adaptive plasticity related to synapse formation [38], stabilization of neuronal populations [9], long-term potentiation [1]and memory [23]. Thus excitatory amino acids are beneficial under some circumstances and deleterious under others, and there must be other factors involved in the mechanisms for causing damage. A third factor in producing hippocampal damage is serotonin. We have developed a model of stress-induced atrophy of the hippocampus of rats at the cellular level and have been investigating underlying mechanisms in search of agents that will block the atrophy. Repeated restraint stress of cats for 3 weeks causes changes in the hippocampal formation that include suppression of 5-HT1A receptor binding and atrophy of dendrites of CA3 pyramidal neurons 21, 35. Three weeks of 6 h/day restraint stress caused not only dendritic atrophy but also impairment of initial learning of a radial arm maze task [18]. Because serotonin is released by stressors and may play a role in the actions of stress on nerve cells, we investigated the actions of agents that facilitate or inhibit serotonin reuptake. Tianeptine is known to enhance serotonin uptake and thus remove it from extracellular interactions with serotonin receptors [22], and tianeptine treatment prior to daily restraint stress blocked stress-induced atrophy of CA3 pyramidal neurons [33]and prevented stress-induced impairment of radial maze learning [18]. This review will summarize these results in studies on the rat model and will then discuss the potential relevance to the human hippocampus and to human aging, where hippocampal atrophy occurs in some individuals and is a risk factor associated with later dementia 3, 4, 8”. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0924977X97000643?dgcid=api_sd_search-api-endpoint
[E] “A formação do hipocampo é um importante componente do sistema límbico, juntamente com a amígdala e a área septal (embora alguns também incluam o giro [circunvolução] do cíngulo e o córtex pré-frontal como parte desse sistema). A palavra “hipocampo” deriva das palavras gregas “hippos”, que significa cavalo, e “kampos”, que significa monstro marinho, e se refere à forma da estrutura que se assemelha a um cavalo-marinho” [https://www.kenhub.com/pt/library/anatomia/hipocampo-anatomia-e-funcoes]. O papel do hipocampo é central na formação e armazenamento de novas memórias e também conecta emoções a tais memórias, além de organizá-las. Também garante que as memórias sejam consolidadas ao longo do sono. O trágico é, como foi explicado, que grande parte dos medicamentos psiquiátricos – além dos seus outros efeitos antimetabólicos e patogênicos - impactam negativamente o hipocampo.
***