O estrogênio cai na menopausa. Será verdadeɁ Você já ouviu falar da estrona [E1]Ɂ [PARTE 2 de 2]
O segredo revelado: não, o estrogênio não cai na menopausa, ele AUMENTA. A chave começa no entendimento do papel da estrona [E1], do estradiol [E2] e do estriol [E3].
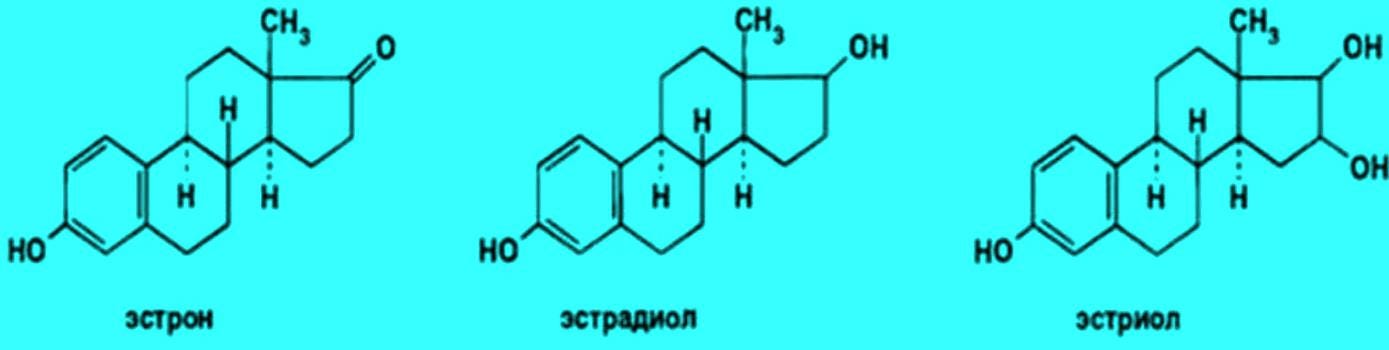
[Moléculas de estriol, estradiol e estrona. Fonte: studbooks.net]
Como foi explicado na nota anterior [Ver aqui], na menopausa, estrona e prolactina sobem, sustentadamente.
E a hipótese mais plausível, nesse sentido, é a de que ao mesmo tempo em que as mulheres pós-menopausadas estão ganhando tecido adiposo, também terão seus níveis de estradiol [E2] declinando; só que o tecido adiposo será usado para produção de estrona, perfeitamente conversível em estradiol nos tecidos.
De onde se conclui que, com o envelhecimento, aumenta a atividade de estrogênio – estradiol – nos tecidos. A partir da escalada da estrona.
Por outro lado, aquele ganho de peso tem a ver com um metabolismo declinante.
Metabolismo mais lento, elétrons sobrantes, que não são captados pelo oxigênio, não terminam virando CO2, sobra NADH, aqueles elétrons terminam como ácidos graxos ou como radicais livres. Como explica Dinkov: “aqueles elétrons extra que o corpo não consegue parear com o oxigênio, precisam ir para algum lugar, portanto, sintetizar gordura ou armazenar gordura dietética é uma maneira subótima de manejar o excesso de NADH. A gordura extra contribui, então para mais síntese de estrona.
Por outro lado, é virtualmente impossível se tornar deficiente em estrogênio já que basicamente qualquer célula/tecido pode sintetizá-lo. Finalmente, as reservas de estrogênio total crescem com a idade” [B].
UM NECESSÁRIO PARÊNTESIS SOBRE A ESTRONA E OS TRES ESTRÓGENOS
A medicina costuma considerar a estrona [E1] como uma forma fraca de estrogênio, no entanto, é o principal estrógeno produzido perifericamente por homens e mulheres [sobretudo em tecido adiposo]. E que facilmente vira estradiol [E2].
A síntese de estrona aumenta com a idade, e o tecido gordo apresenta alta expressão da aromatase, constituindo grande reservatório de estrogênio no organismo.
Como já foi mencionado, essa forma de estrogênio, a estrona, pode ser facilmente convertida em estradiol e estriol, conforme a demanda. Ora, o estradiol é a forma mais potente das três, muito mais que estriol e bem mais que a fraca estrona.
E o estradiol age nos tecidos. Quem mede estradiol no plasma, erra feio em termos de avaliação dos estrógenos no sistema.
O problema é a estrona. A estrona é considerada como um pró-hormônio ou precursor do estradiol.
O sulfato de estrona [E1S] é sua forma de mais longa duração, de armazenamento e, no real, pode funcionar como um bom preditor para câncer de mama e de próstata [B].
Por algum tempo, a medicina considerou o sulfato de estrona como um resíduo do estrogênio. Agora está mais que claro que não; e que é, na verdade, a forma de armazenamento da estrona por longo prazo. E que circula, sendo convertido em estradiol, o mais potente, em qualquer tecido que esteja estressado ou desenergizado, como mais de uma vez explicou R. Peat.
Em resumo: estrona [E1] seria um estrógeno relativamente inativo. Ao passo que o estradiol é o estrógeno natural mais potente. Mais patogênico.
E reiterando: ao contrário do que pensava o pesquisador Elwood Jensen, R. Peat já mostrou mais de uma vez que o estradiol se converte em estrona e estriol, conforme o estado energético do sistema celular. Estrona alta pode virar estradiol muito facilmente e em qualquer tecido, por exemplo, inflamado.
Como explica R. Peat, “Quaisquer dos sintomas da menopausa podem ser produzidos por excesso de estrogênio e pouca progesterona”.
Nenhuma das três formas de estrogênio é protetora da saúde [sem oposição da progesterona]. Se o estriol estiver alto, estará apenas indicando que o estradiol, mais potente, está sendo detoxificado, o que é melhor para a saúde, por um lado. Mas os três estrógenos, estriol, estrona e estradiol são um problema quando em excesso em relação à progesterona.
Portanto, é possível afirmar que o problema de médicos continuarem afirmando que o estrogênio decai na menopausa decorre da sua equivocada forma de avaliação.
Ficam medindo estradiol quando sabemos que este tenderá a ser baixo quando os ovários entrem em falência [já que maior parte do estradiol no sangue vem dos ovários]. Deveriam medir sulfato de estrona, que aumenta, sim, na menopausa – fica muito alto - e é facilmente convertido em estradiol. E daqui vem o risco da subida dos estrógenos na menopausa.
Estradiol é dez vezes mais forte do que aqueles e vai aparecer em abundância, nos tecidos, quando há falta de progesterona ou um processo de estresse, de inflamação.
Quando o estrogênio plasmático passa por um tecido inflamado ele é captado, liberando ácido glicurônico e sulfato da sua molécula.
Quando o estado das células muda, para oxidado, o poderoso estradiol é convertido em estrona e liberado no plasma. “É a sua redução que torna o estrogênio tóxico, ao assumir sua forma mais ativa” [R. Peat].
Os tecidos possuem enzimas que ativam ou desativam estrógenos.
Glucoronidase e sulfatase ativam estrogênio nos tecidos. Inflamação as ativa. Assim como inflamação ativa aromatase, enzima sintetizadora do estrogênio. Progesterona, por sua vez, impede que estrona se converta em estradiol.
Por sua vez, em boas condições metabólicas, o estradiol pode ser oxidado na direção de estrona e estriol, o que reduz sua atividade estrogênio-like. E sua agressividade patogênica.
É decisiva a presença de progesterona. Quando o organismo está saudável, excesso de estrogênio – por exemplo, da ovulação – pode ser eliminado em doze horas.
A progesterona destrói receptores de estrogênio. Na ausência de suficiente progesterona, enzimas convertem estrogênio em sua forma mais ativa, a partir da estrona e do sulfato de estrona.
“Anti-estrógenos e progesterona diminuem significativamente a captação e os níveis de estradiol em linhas de células do câncer mamário hormônio-dependentes” [C].
Estradiol, estrona e estriol se convertem entre si, um no outro, tudo depende do ambiente no tecido. Mas a presença de progesterona, por exemplo, impede que a forma mais ativa de estrogênio se imponha.
Progesterona desliga enzimas que ativam estrogênio e ativa enzimas que desativam estrogênio.
O ambiente mais ou menos dominado pela progesterona é que decide que tipo de estrogênio irá prevalecer.
E é assim que se pode entender a menopausa. A carência de progesterona na pós-menopausa é que fará, por exemplo, que estradiol seja dominante nos tecidos, a partir da conversão da estrona plasmática.
Fora dessa percepção fisiológica, facilmente o doutor ficará refém das aparências e tenderá a imaginar que se o estradiol cai no plasma é porque ele também está baixo nos tecidos. O que não é verdade, ao contrário.
E será por conta desse autoengano – aliás completamente conveniente para a indústria de “reposição” do estrogênio – que serão perpetuados dogmas e mitos que não podem fazer nenhum bem à paciente pós-menopausada; e danos, iatrogenia serão perpetrados. Esse é o entendimento de R. Peat.
GM Fontes, Brasília 12-2-24
As informações aqui presentes não pretendem servir para uso diagnóstico, prescrição médica, tratamento, prevenção ou mitigação de qualquer doença humana. Não pretendem substituir a consulta ao profissional médico ou servir como recomendação para qualquer plano de tratamento. Trata-se de informações com fins estritamente educativos.
Referências ___________________
[A] DAVIS, S, 2019. Higher testosterone level may confer ‘survival advantage’ in older women. August 21, 2019. Sex steroid levels, particularly levels of estrone and testosterone, vary widely among older women, with higher levels of testosterone possibly indicating lower risk for disease, according to findings published in The Journal of Clinical Endocrinology & Metabolism. Perspective from Sharon Parish, MD - “Estrone is the major source of circulating estrogen in older women and must be measured in any study seeking to determine the association between estrogens and health outcomes in older women,” Susan Davis, MBBS, FRACP, PhD, FAHMS, a professor in the School of Public Health and Preventive Medicine at Monash University, Australia, told Endocrine Today. “Consistent with previous studies, there are some older women with surprisingly high estrone levels, and this needs to be better understood. This study establishes that women beyond the age of 70 years have similar blood testosterone concentrations to those seen in healthy premenopausal women.”
In a cross-sectional study, Davis and colleagues analyzed sex steroid data from 6,392 women aged at least 70 years participating in ASPREE, a randomized controlled trial assessing the effect of low-dose aspirin vs. placebo on older adults without cardiovascular disease or impaired cognition at recruitment (98% European ancestry; mean BMI, 28 kg/m²). Researchers assessed sex steroids and sex hormone-binding globulin levels using liquid chromatography-tandem mass spectrometry.
“Until now, the available data have been limited by small sample sizes and/or the use of direct immunoassays, which lack sensitivity and specificity for the measurement of testosterone at the concentrations occurring in women, compared with the higher levels seen in men,” the researchers wrote.
Sex steroid levels, particularly levels of estrone and testosterone, vary widely among older women, with higher levels of testosterone possibly indicating lower risk for disease. A reference group to establish sex steroid, age-specific reference ranges (n = 5,326) excluded women using systemic or topical sex steroids, antiandrogen or glucocorticoid therapy or diabetes medications (mean age, 75 years).
Among the reference group population, median estrone level was 181.2 pmol/L, median testosterone level was 0.38 nmol/L, median dehydroepiandrosterone (DHEA) level was 2.6 nmol/L and median SHBG level was 41.6 nmol/L. Estradiol and dihydrotestosterone (DHT) levels were below the sensitivity of the assay method in 66.1% and 72.7% of women, respectively. “There were a number of outliers for each steroid in each age group,” the researchers wrote. “We examined whether any of the measured variables (BMI, weight, waist circumference, smoking) and any reported medication use predicted extreme outliers for any of the steroids, but could not identify a common explanation for the outliers.”
Researchers found that women aged 80 to 84 years had estrone levels that were on average 9.2% higher vs. women aged 70 to 74 years (P = .001); women aged at least 85 years had estrone levels that were on average 11.7% higher vs. women aged 70 to 74 years (P = .01). When stratified by BMI, excess weight further influenced sex steroid levels, the researchers wrote, noting that older women with obesity had estrone levels that were on average 34.1% higher vs. women with normal weight (P < .001).
Similarly, women aged 80 to 84 years had testosterone levels that were on average 9.3% higher vs. women aged 70 to 74 years; that percentage rose to 11.3% for women aged at least 85 years (P = .02). Older women with overweight and obesity had higher testosterone levels vs. women with normal weight. Researchers also found that, compared with women aged 70 to 74 years, SHBG levels were on average 5.6% higher among women aged 75 to 79 years, 13.6% higher in women aged 80 to 84 years and 22.7% higher in women aged at least 85 years (P < .001 for all). Obesity, however, was associated with a 27% lower SHBG level (P < .001).
“The increasing proportion of women with unmeasurable [estradiol] in the older groups most likely reflects different effects of age on the enzymatic pathways essential for the biosynthesis of these hormones,” the researchers wrote. “Regardless, a key message from the findings is that studies investigating the association between estrogens and diseases of aging in postmenopausal women must measure [estrone] in order to provide meaningful findings.”
The researchers noted that the high androgen levels observed in some women in the cohort reaffirm the “wide range of normality” within a community-based population and support the representativeness of the study sample.
“The study suggests that higher testosterone may confer a survival advantage, particularly considering that between the ages of 70 to 95 years, older women have higher testosterone levels in this age group,” Davis said. – by Regina Schaffer
For more information:
Susan R. Davis, MBBS, can be reached at the Women’s Health Research Program, Monash University School of Public Health and Preventive Medicine, 553 St. Kilda Road, Melbourne 3004, Australia; email: susan.davis@monach.edu.
Disclosures: The authors report no relevant financial disclosures.
Sharon Parish, MD
This is new information, and it provides a starting point for better understanding the association between sex steroids and some of what we study related to androgens in women.
There is a widely held belief that declining testosterone levels are responsible for changes in sexual function in women as they age. Additionally, there is a lot of discussion about how useful it is to measure testosterone or other androgens to assess or appraise sexual function. What follows is whether measuring androgens confers a predictive value as to whether women will benefit from supplementation, and whether androgen levels are perhaps biomarkers for longevity. This study provides more complexity, but also more information, about whether this question of whether testosterone decline with age has a relationship to sexual function. What is striking here is that we now have good measurements providing age-specific data, which we did not have before, suggesting that testosterone levels went up and were higher among women as they age.
The authors are not commenting about the relationship between these measurements and global sexual function, so I would like to see how this fits into the schema of what we understand about sexual function. The other interesting finding here is that testosterone and estrone levels go up as DHEA declines. We need to understand how that influences some of the clinical issues related to androgen levels.
Sharon Parish, MD - Professor of Clinical Medicine in Clinical Psychiatry - Weill Cornell Medical College - Disclosures: Parish reports she has served as a consultant for AMAG Pharmaceuticals, Dare Bioscience, JDS Therapeutics, Procter & Gamble, Sprout, Strategic Science & Technologies and Therapeutics MD, served on an advisory board for AMAG Pharmaceuticals and has received writing support from AMAG, Sprout and Therapeutics MD.
Source: Davis SR, et al. J Clin Endocrinol Metab. 2019;doi:10.1210/jc.2019-00743.
Disponível em: https://www.healio.com/news/endocrinology/20190821/higher-testosterone-level-may-confer-survival-advantage-in-older-women
[[B] https://raypeatforum.com/community/threads/test-for-estrogenic-activity-and-prostate-cancer.7886/ e https://raypeatforum.com/community/threads/while-estradiol-falls-estrone-rises-with-age-and-is-much-more-relevant-for-estrogen-driven-diseases.30568/
[C] PASQUALINI J R GELLY C NGUYEN B L, 1989. Importance of estrogen sulfates in breast cancer. Journal of Steroid Biochemistry Volume 34, Issues 1–6, 1989, Pages 155-163 https://doi.org/10.1016/0022-4731(89)90077-0Get rights and content “Estrogen sulfates are quantitatively the most important form of circulating estrogens during the menstrual cycle and in the post-menopausal period. Huge quantities of estrone sulfate and estradiol sulfate are found in the breast tissues of patients with mammary carcinoma. It has been demonstrated that different estrogen-3-sulfates (estrone-3-sulfate, estradiol-3-sulfate, estriol-3-sulfate) can provoke important biological responses in different mammary cancer cell lines: there is a significant increase in progesterone receptor. On the other hand, no significant effect was observed with estrogen-17-sulfates. The reason for the biological response of estrogen-3-sulfates is that these sulfates are hydrolyzed, and no sulfatase activity for C17-sulfates is present in these cell lines.
[3H]Estrone sulfate is converted in a very high percentage to estradiol (E2) in different hormone-dependent mammary cancer cell lines (MCF-7, R-27, T-47D), but very little or no conversion was found in the hormone-independent mammary cancer cell lines (MDA-MB-231, MDA-MB-436). Different anti-estrogens (tamoxifen and derivatives) and another potent anti-estrogen: ICI 164,384, decrease the concentration of estradiol very significantly after incubation of estrone sulfate with the different hormone-dependent mammary cancer cell lines. No significant effect was observed for the uptake and conversion of estrone sulfate in the hormone-independent mammary cancer cell lines. Progesterone provokes an important decrease in the uptake and in estradiol levels after incubation of [3H]estrone sulfate with the MCF-7 cells.
It is concluded that in breast cancer: (1) Estrogen sulfates can play an important role in the biological response of estrogens; (2) Anti-estrogens and progesterone significantly decrease the uptake and estradiol levels in hormone-dependent mammary cancer cell lines; (3) The control of the sulfatase and 17β-hydroxysteroid dehydrogenase activities, which are key steps in the formation of estradiol in the breast, can open new possibilities in the treatment of hormonedependent mammary câncer”. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/0022473189900770
***