Exames radiológicos: não fazem mal algum [ou são causa de câncer]?
Exposição a radiação ionizante, comprovadamente aumenta estrogenização e o estrogênio é faz parte das causas de câncer [de mama, por exemplo].
É senso comum médico que exames de radiação ionizante tipo PET-Scan, RX, tomografia, mamografia, panorâmicas na boca não fazem mal algum.
São exames completamente naturalizados como se fossem um copo d´água ou o ar que se respira. Nenhum debate é feito, as críticas são canceladas, os congressos médicos silenciam.
Enquanto isso, acumulam-se artigos científicos – mantidos à sombra – mostrando o exato oposto [B][C][D].
Como mostra artigo publicado já há dez anos [A]: “exposição a radiação ionizante é um fator de risco estabelecido para o câncer de mama”. E continua: “exposição a radiação durante a infância e adolescência conferem o maior risco”. Não conhecemos os mecanismos, dizem os pesquisadores, mas “radiação é um comprovado carcinógeno mamário”[A].
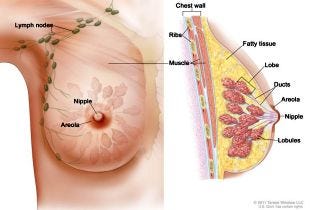
O citado trabalho mostra que quando o animal é alvo de radiação ionizante, ele terá seus níveis de estrogênio aumentados e, em especial, acumulados nas mamas, comparado com grupo de animais controle. E mais, esses níveis altos de estrogênio persistem aumentados durante até um ano da exposição aos RX.
[Imagem: pixabay]
Daí o trabalho conclui: “tomados de conjunto, nossos dados não apenas dão apoio a observações epidemiológicas associando radiação a câncer de mama, mas também desvenda eventos moleculares que poderão estar envolvidos no câncer induzido por radiação”.
Não é o que a medicina costuma mencionar. Ao contrário, ou não se discute esse tema ou ele é classificado como controverso, falacioso [SCOTT, B R: 2008] e alegam que baixa dose de radiação é inócua.
No entanto, estudiosos de longa data a respeito do tema - autores de livros de pesquisa sobre o assunto - não concordam [E] com essa hipótese da baixa dose.
O trabalho acima citado chama a atenção para o boost de estrogênio promovido pelos RX como um grande fator de risco para o câncer. Estudos mostram que existe sinergia estrogênio-RX e RX-estrogênio; isto é, “estrogênio promove carcinogenese radiação-induzida” [F]. E mais, vários metabólitos do estrogênio já foram propostos como marcadores para o risco de carcinogênese mamária [G][H]
Estudos pioneiros do Dr R Peat já demonstraram à náusea o papel do estrogênio na gênese do câncer [ao provocar hipóxia nos tecidos e inibir a respiração oxidativa, com resultante proliferação celular] e nesse terreno pairam poucas dúvidas [I][J], ainda que jamais alcancem os domínios da medicina mainstream; de fato, são estudos científicos, mas não ganham poder de mudar protocolos ou gerar debates na medicina, uma questão que só pode ser de natureza não médica, ou política.
De toda forma, o estudo acima citado [A] tira suas conclusões científicas: “a exposição a radiação induziu mudanças de longo prazo nos niveis e na relação dos metabólitos do estrogênio, com implicações para a proliferação de células epiteliais nas glândulas mamárias” e agrega, como resultado: “exposição a radiação provocou aumento sustentado no estradiol do plasma e no metabólito oncogênico urinário 16 alfaOHE1” [A]. As implicações deste fato são maior risco de câncer de mama. Esse fenômeno já tinha sido observado em sobreviventes das radiações ionizantes da bomba atômica [K][L].
[Imagem: cancer.gov]
Em várias esferas científicas já não pairam dúvidas de que aumento sustentado de estrogênio promove câncer, no caso, câncer de mama [M][N].
.O que levaria a uma conclusão lógica: qualquer fator que aumente continuamente os níveis de estrogênio no organismo, aumentará risco de câncer. A exemplo da menopausa, quando o estrogênio não mais encontra a oposição da progesterona e pode agir livremente, fica proporcionalmente mais alto, criando problemas crônico-degenerativos, inclusive câncer [O].
E portanto, quando se fala em câncer é preciso pensar em estrogênio. E em radiação ionizante, que promove aumento sustentado de estrogênio sérico. Além dos estrógenos ambientais que nos chegam através dos plásticos, da água encanada [que inclui o cancerígeno flúor], da poluição ambiental em geral.
No entanto, se há uma coisa que pode ser chamada de barreira contra a vida é o cancelamento do debate médico sério de temas como esse, especialmente quando uma big indústria [dos diagnósticos de imagem, da oncologia dominante] lucram horrores com o não-debate. E grudam o rótulo de “desinformação” a tudo que nao fizer parte da narrativa do cartel médico.
GMF, Brasília, 25-12-22
[As informações aqui presentes não pretendem servir para uso diagnóstico, prescrição médica, tratamento, prevenção ou mitigação de qualquer doença humana. Não pretendem substituir a consulta ao profissional médico ou servir como recomendação para qualquer plano de tratamento. São informações com fins estritamente educativos].
Referência:
[A] SUMAN, S, JOHNSON, M D, 2012. Exposure to Ionizing Radiation Causes Long-Term Increase in Serum Estradiol and Activation of PI3K-Akt Signaling Pathway in Mouse Mammary Gland. Int J Radiat Oncol Biol Phys. 2012 Oct 1; 84(2): 500–507.. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3580184/
[B] RONCKERS C, M, ERDMANN C A, 2005. Radiation and breast cancer: A review of current evidence. Breast Cancer Res. 2005;7:21–32. [PMC free article] [PubMed] [Google Scholar]
[C] BOICE, J D J, 1992. Cancer in the contralateral breast after radiotherapy for breast cancer. N Engl J Med. 1992;326:781–785. [PubMed] [Google Scholar]
[D] BRENNER, D J, DOLL R, 2003. Cancer risks attributable to low doses of ionizing radiation: Assessing what we really know. Proc Natl Acad Sci U S A. 2003;100:13761–13766. [PMC free article] [PubMed] [Google Scholar]
[E] GOFMAN, J W, MD, 1990. Low-dose exposure: na independent analysis. USA: Commitee for Nuclear Responsibility, Inc. Do mesmo autor, Radiation and human health, 1981 e X-Rays: health effects of common exams, de 1985.
[F] Segaloff A, Maxfield WS. The synergism between radiation and estrogen in the production of mammary cancer in the rat. Cancer Res. 1971;31:166–168. [PubMed] [Google Scholar]
[G] URSIN, G, 1997. A pilot study of urinary estrogen metabolites (16alpha-OHE1 and 2-OHE1) in postmenopausal women with and without breast cancer. Environ Health Perspect. 1997;105(Suppl 3):601–605. [PMC free article] [PubMed] [Google Scholar]
[H] IM A, VOGEL V G, 2009. Urinary estrogen metabolites in women at high risk for breast cancer. Carcinogenesis. 2009;30:1532–1535. [PMC free article] [PubMed] [Google Scholar]
[I] KAZI, A A, MOLITORIS K H, 2009. Estrogen rapidly activates the PI3K/AKT pathway and hypoxia-inducible factor 1 and induces vascular endothelial growth factor A expression in luminal epithelial cells of the rat uterus. Biol Reprod. 2009;81:378–387. [PMC free article] [PubMed] [Google Scholar]
[J] BOSE, S, CHANDRAN S, 2006. The Akt pathway in human breast cancer: A tissue-array-based analysis. Mod Pathol. 2006;19:238–245. [PubMed] [Google Scholar]
[K] GRANT, E J, NERIISHI K, 2011. Associations of ionizing radiation and breast cancer-related serum hormone and growth factor levels in cancer-free female A-bomb survivors. Radiat Res. 2011;176:678–687. [PMC free article] [PubMed] [Google Scholar]
[L] KABUTO, M, AKIBA S, 2009. A prospective study of estradiol and breast cancer in Japanese women. Cancer Epidemiol Biomarkers Prev. 2000;9:575–579. [PubMed] [Google Scholar]
[M] CHERIYATH V, KUHNS, M A, 2011. G1P3, an interferon- and estrogen-induced survival protein contributes to hyperplasia, tamoxifen resistance and poor outcomes in breast cancer. Oncogene. 2011 In press. [PubMed] [Google Scholar]
[N] LAI, J N, 2008. Increased risk for invasive breast cancer associated with hormonal therapy: A nation-wide random sample of 65,723 women followed from 1997 to 2008. PLoS ONE. 2011;6 e25183. [PMC free article] [PubMed] [Google Scholar]
[O] MIYOSHI Y, TANJI Y, 2003. Association of serum estrone levels with estrogen receptor-positive breast cancer risk in postmenopausal Japanese women. Clin Cancer Res. 2003;9:2229–2233. [PubMed] [Google Scholar]
***